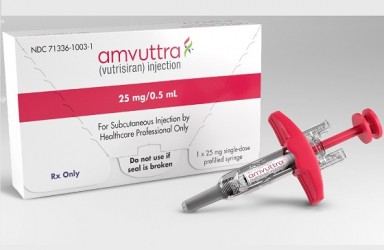
2022年06月13日(马萨诸塞州剑桥),Alnylam公司宣布,美国FDA批准皮下注射RNAi疗法Amvuttra(vutrisiran)上市,用于治疗遗传性转甲状腺素蛋白介导(hATTR)的淀粉样变性成人患者的多发性神经病(polyneuropathy)。
Amvuttra(vutrisiran)是FDA批准的第1款只需每3个月皮下注射一次,就能够逆转神经病损伤的RNAi疗法。
FDA 的批准是基于 HELIOS-A 3 的随机、开放标签、全球性3期临床试验结果。试验结果显示,Amvuttra达到主要终点,接受治疗9个月后,Amvuttra组的mNIS+7评分(评估神经病障碍的评分)与基线相比降低2.2点(意味着症状改善),而外部对照组评分增加14.8点(意味着症状恶化,p<0.0001)。9个月时,50%的患者与基线相比症状得到改善。Amvuttra同时达到试验的所有次要终点。并且在接受治疗后18个月时,疗效数据与9个月时一致。
Amvuttra(vutrisiran)是一种皮下给药RNAi治疗药物,开发用于治疗ATTR淀粉样变性,包括hATTR和野生型ATTR(wtATTR)淀粉样变性。它通过靶向和沉默特定的mRNA,阻断野生型和变体转甲状腺素蛋白(TTR)的产生。Vutrisiran基于Alnylam的增强稳定化学(ESC)-GalNAc偶联递送平台设计,增加了效力和代谢稳定性,可能允许不频繁的皮下注射。此前研究数据表明,每季度给予患者vutrisiran可能有助于减少组织中的沉积,促进TTR淀粉样沉积物的清除,并有望恢复这些组织的功能。
遗传性转甲状腺素蛋白介导淀粉样变性导致的多发性神经病(ATTR-PN)是一种遗传性、进行性导致衰弱的致死性疾病,由TTR基因突变引起。TTR蛋白主要在肝脏中产生,正常情况下是维生素A的载体。TTR基因变异导致异常淀粉样蛋白蓄积,并损伤身体器官和组织,如外周神经和心脏,导致顽固性外周感觉-运动神经病变、自主神经病变和/或心肌病,以及其他疾病表现。hATTR淀粉样变性具有重大的未满足的医疗需求,患者诊断后的中位生存期仅为4.7年。
| 信息 | 来源 |
| Alnylam Announces FDA Approval of AMVUTTRA™ (vutrisiran), an RNAi Therapeutic for the Treatment of the Polyneuropathy of Hereditary Transthyretin-Mediated Amyloidosis in Adults. | https://www.businesswire.com/news/home/20220603005487/en |
| 免责声明 | 本资料仅作参考,诊疗请遵医嘱。 |
 扫一扫
扫一扫