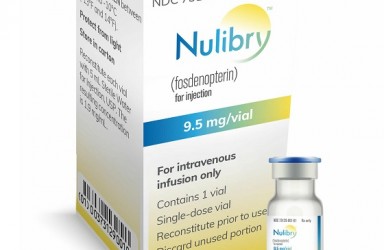
2022年08月10日(加州帕洛阿尔托和加州索拉纳海滩和以色列PETACH TIKVA)BridgeBio Pharma, Inc.(BridgeBio)以及美国 Sentynl Therapeutics, Inc. (Sentynl),以及Medison Pharma,宣布以色列卫生部已批准 NULIBRY® (fosdenopterin) 注射剂作为以色列首个治疗A型钼辅因子缺乏症(MoCD-A型)的疗法,其适应症是降低A型钼辅因子缺乏 (MoCD) 患者的死亡风险。
以色列卫生部的批准得到了三项临床试验数据的支持,这些临床试验与自然史研究的数据相比,证明了 NULIBRY 对 A 型 MoCD 患者的治疗效果。这些研究表明,在自然史研究中,NULIBRY 将死亡风险降低了 82%,并将三年生存概率提高到 84%,而未治疗的基因型匹配的历史对照组为 55%。
动物研究已确定 NULIBRY 具有光毒性潜力。在临床试验中,两名或多名接受 NULIBRY 治疗的 MoCD A 型患者最常见的不良反应是导管相关并发症(89%)、发热(发热;78%)、病毒感染(56%)、肺炎( 44%)、中耳炎(耳部感染;44%)、呕吐(44%)和咳嗽/打喷嚏(44%)。rcPMP 治疗患者的不良反应与 NULIBRY 治疗患者相似。
NULIBRY 于2021年2月获得美国 FDA 批准,用于降低 MoCD A 型患者的死亡风险。2022年7月,CHMP 建议在欧盟批准NULIBRY作为MoCD患者的治疗药物A 类。根据CHMP的建议,欧盟委员会 (EC) 预计将在今年晚些时候对NULIBRY申请做出决定,该决定授权在欧盟的营销申请。
2022年3月,安进获得了NULIBRY的全球权利,负责NULIBRY在美国的持续开发和商业化,以及在全球范围内开发、制造和商业化磷蝶呤。Sentynl 和 BridgeBio 通过与欧洲药品管理局进行加速评估的上市许可申请的批准来分担开发责任。
NULIBRY ® (fosdenopterin) for Injection 是一种底物替代疗法,可提供外源性cPMP来源,可转化为钼蝶呤。然后钼蝶呤被转化为钼辅因子,这是激活钼依赖性酶所必需的,包括亚硫酸盐氧化酶,一种降低神经毒性亚硫酸盐水平的酶。它是第1个也是唯一1个 FDA 批准的用于降低 MoCD A 型患者死亡风险的疗法,临床试验表明,与未治疗的基因型匹配的患者相比,接受 NULIBRY 或 rcPMP 治疗的患者总生存期有所改善,历史对照组。
钼辅因子缺乏症 (MoCD) A 型,是一种常染色体隐性遗传的先天性代谢错误,由钼辅因子合成 1 基因突变引起,其特征是钼辅因子产生不足,导致缺乏钼依赖性酶活性。缺乏活性导致亚硫酸盐氧化酶活性降低,亚硫酸盐和次级代谢物(如 S-磺基半胱氨酸)在大脑中积聚,从而导致不可逆的神经损伤。
MoCD A 型最常见的症状是癫痫发作、喂养困难和脑病。存活超过婴儿期的 MoCD A 型患者通常会遭受进行性脑损伤,这在磁共振成像 (MRI) 上呈现出特征性模式。这种损伤会导致严重的精神运动障碍以及无法进行协调运动或与环境交流。
| 信息 | 来源 |
| BridgeBio Pharma, Sentynl Therapeutics and Medison Pharma Announce Approval in Israel for NULIBRY® (fosdenopterin) for the Treatment of MoCD Type A | https://www.prnewswire.com/news-releases/bridgebio-pharma-sentynl-therapeutics-and-medison-pharma-announce-approval-in-israel-for-nulibry-fosdenopterin-for-the-treatment-of-mocd-type-a-301603070.html |
| 免责声明 | 本资料仅作参考,诊疗请遵医嘱。 |
 扫一扫
扫一扫