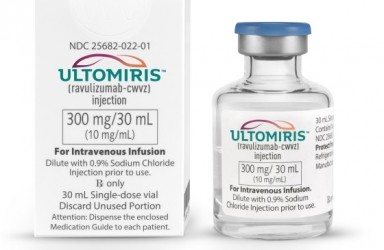
2022年09月23日,AZ Alexion表示Ultomiris (ravulizumab) 已在欧洲获批,作为标准疗法的附加疗法,用于治疗抗乙酰胆碱受体 (AChR) 抗体阳性的全身性重症肌无力 (gMG) 成人患者。
- 这一决定标志着欧洲第1个也是唯一1个批准用于治疗 gMG 的长效 C5 补体抑制剂。
欧盟委员会的批准遵循了人用医药产品委员会的积极意见,并基于 CHAMPION-MG III 期试验的结果,该试验在线发表在NEJM Evidence上。在试验中,Ultomiris在第 26 周的重症肌无力-日常生活活动 (MG-ADL) 总分的主要终点变化方面优于安慰剂,这是一种评估患者执行能力的患者报告量表日常活动。此外,在开放标签扩展的长期随访结果中,在60 周内观察到Ultomiris的临床益处。
在 CHAMPION-MG 中, Ultomiris的安全性与安慰剂相当,并且与Ultomiris 在阵发性夜间血红蛋白尿 (PNH) 和非典型溶血性尿毒症综合征 (aHUS) 的 III 期试验中观察到的一致 。接受Ultomiris的患者最常见的不良反应是腹泻、上呼吸道感染、鼻咽炎和头痛。
AstraZeneca Alexion:阿斯利康(AstraZeneca)罕见病,是阿斯利康(AstraZeneca)旗下专注于罕见病的集团,是在 2021年收购 Alexion Pharmaceuticals, Inc. 后创建的。
全身性重症肌无力(gMG)是一种罕见的、使人衰弱的慢性自身免疫性神经肌肉疾病,会导致肌肉功能丧失和严重虚弱。在欧盟,诊断出的 gMG 患病率估计约为 89,000。gMG可以发生在任何年龄,但最常见于40岁之前的女性和60岁之后的男性。最初的症状可能包括口齿不清、复视、眼睑下垂和缺乏平衡;随着疾病的进展,这些通常会导致更严重的症状,例如吞咽障碍、窒息、极度疲劳和呼吸衰竭。
80%的gMG患者 AChR 抗体呈阳性,这意味着他们会产生特异性抗体(抗 AChR),这些抗体与神经肌肉接头 (NMJ) 处的信号受体结合,这是神经细胞与其控制的肌肉之间的连接点。这种结合会激活补体系统,这对于身体防御感染至关重要,从而导致免疫系统攻击 NMJ。这会导致炎症以及大脑和肌肉之间的交流中断。
Ultomiris (Ravulizumab)雷夫利珠单抗 是第1个也是唯一1个长效 C5 补体抑制剂,可提供即时、完全和持续的补体抑制。该药物通过抑制终末补体级联中的 C5 蛋白起作用,这是人体免疫系统的一部分。当以不受控制的方式激活时,补体级联反应过度,导致身体攻击自己的健康细胞。 Ultomiris 在成年患者中每8周静脉内给药,在负荷剂量之后。
Ultomiris于2022年4 月在美国和2022年8月在日本获得批准,用于某些患有gMG的成年人。其他国家/地区正在进行监管审查。Ultomiris在美国、欧盟和日本被批准用于治疗某些患有 gMG 的成年人。Ultomiris在美国、欧盟和日本也被批准用于治疗某些患有PNH的成年人以及患有PNH 儿童。 此外,Ultomiris在美国、欧盟和日本被批准用于某些患有 aHUS 的成人和儿童,以抑制补体介导的血栓性微血管病。作为广泛开发计划的一部分,正在评估Ultomiris用于治疗其他血液学和神经学适应症。
| 信息 | 来源 |
| Ultomiris approved in Europe for the treatment of adults with generalised myasthenia gravis | https://www.astrazeneca.com/media-centre/press-releases/2022/ultomiris-approved-in-eu-for-gmg.html |
| 免责声明 | 本资料仅作参考,诊疗请遵医嘱。 |
 扫一扫
扫一扫