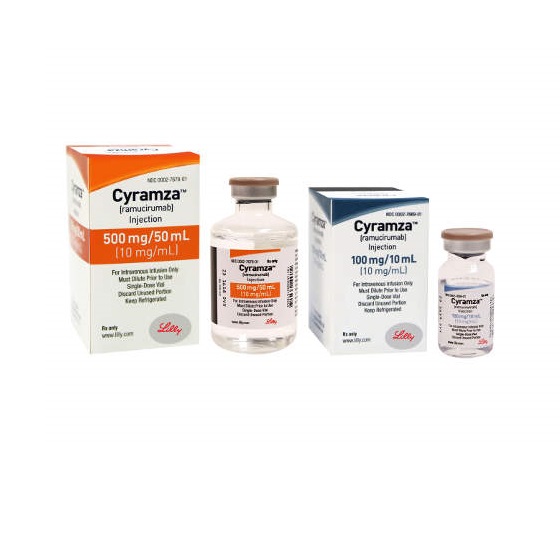
在美国,雷莫芦单抗已获FDA批准:
- 作为单药或联合紫杉醇(paclitaxel)用于接受含氟尿嘧啶或含铂化疗期间或化疗后病情进展的晚期或转移性胃或胃食管交界腺癌(GEJA)患者;
- 联合多西他赛用于含铂化疗期间或化疗后病情恶化的转移性非小细胞肺癌(NSCLC)患者;
- 联合FOLFIRI方案用于既往接受贝伐单抗、奥沙利铂和氟尿嘧啶期间或之后病情进展的转移性结直肠癌(mCRC)患者;
- 作为一种单药疗法,用于治疗甲胎蛋白(AFP)≥400ng/mL并且接受sorafenib(索拉非尼)治疗的肝细胞癌(HCC)患者。
2019年10月07日 礼来制药(Eli Lilly)官宣,雷莫芦单抗与厄洛替尼联合一线治疗转移性EGFR突变非小细胞肺癌(NSCLC)患者的全球性III期临床研究RELAY的结果发表于《柳叶刀肿瘤学》(The Lancet Oncology)。
该研究是一项全球随机、双盲、安慰剂对照研究,评估了雷莫芦单抗与厄洛替尼相对于安慰剂联合厄洛替尼一线治疗既往未接受治疗的转移性NSCLC患者,这些患者的肿瘤中存在EGFR外显子19缺失或外显子21(L858R)替代突变。研究于2015年开始,对北美、欧洲和亚洲449例患者进行了随机分组。主要终点是无进展生存期(PFS),次要终点包括安全性、缓解率、总生存期(OS)和患者报告结果。
结果显示,该研究达到了主要终点,与安慰剂+厄洛替尼治疗组(n=225)相比,雷莫芦单抗+厄洛替尼治疗组(n=224)PFS具有统计学意义和临床意义的改善:
- 中位PFS:19.4个月 vs 12.4个月;HR=0.59,95%CI:0.46-0.79,p<0.0001
此外
- 在所有次要和探索性终点方面均持续观察到雷莫芦单抗+厄洛替尼治疗的改善,包括缓解持续时间、疾病第二次进展时间(PFS2)、靶向治疗时间。
- 在所有指定的亚组中,包括有19号和21号外显子突变的肿瘤患者,也都有持续的改善。总生存期(OS)在数据分析时间点还不成熟。
- 在此次中期评估时没有发现对OS的损害,研究将继续推进,直至达到OS事件的最终数量。
可靶向突变在确定非小细胞肺癌治疗方案中起着关键作用。第一代和第二代EGFR-TKI一线治疗获得性耐药最常见的机制是T790M突变,约30%-60%的患者病情进展过程中获得了该突变。
- 在RELAY研究中,各治疗组间随疾病进展T790M突变率相似。
研究中,观察到的安全性与以往雷莫芦单抗 III期临床研究以及厄洛替尼已建立的安全性相一致。与安慰剂+厄洛替尼治疗组相比,雷莫芦单抗+厄洛替尼治疗组发生率更高(差异≥5%)的最常见(发生率>5%)3级及以上不良事件为高血压、痤疮样皮疹和腹泻。
RELAY研究也是评估Cyramza治疗转移性NSCLC方面取得积极数据的第二个III期研究。在之前的III期临床研究REVEL中,与安慰剂+多西他赛方案相比,雷莫芦单抗+多西他赛方案在接受含铂化疗治疗局部晚期或转移性疾病期间或之后病情进展的转移性NSCLC患者中显著延长总生存期(OS),达到了研究的主要终点,同时也达到了次要终点PFS和缓解率。来自REVEL研究的数据支持了目前的雷莫芦单抗二线治疗NSCLC适应症。
RELAY研究结果是提交雷莫芦单抗+厄洛替尼一线治疗EGFR激活突变NSCLC的全球监管申请文件的基础,礼来已经在美国和欧盟提交了申请,该公司计划在年底前在日本提交申请。
 扫一扫
扫一扫