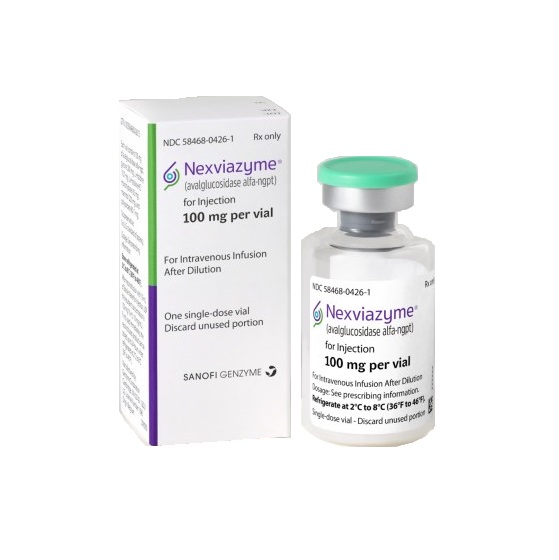
2021年08月06日,美国FDA宣布批准赛诺菲(Sanofi)的酶替代疗法(ERT)Nexviazyme(avalglucosidase α-ngpt)上市,用于治疗1岁及以上的晚发性庞贝病(late-onset Pompe disease,LOPD)患者。
- 庞贝病又称糖原累积病Ⅱ型、酸性-α-葡糖苷酶缺乏症
本次批准是基于关键性3期临床试验COMET获得的积极结果,试验数据证明,Nexviazyme可以为患者提供步行距离和呼吸功能指标的改善。具体主要结果如下所示:
第49周时,试验达到改善呼吸功能的主要终点。即与基线相比,Nexviazyme组的用力肺活量预测值百分比(FVC percent predicted)改善2.9分(SE=0.9)。与对照组相比,Nexviazyme组的FVC预测值百分比改善2.4分,达到非劣效性标准(p=0.0074;95% CI,-0.13,4.99),但未达到统计学优效性(p=0.06)。
在通过6分钟步行测试(6MWT)测量患者功能耐力与活动能力的关键次要终点上,第49周时,与基线相比,Nexviazyme组步行距离为32.2米(SE=9.9,95% CI,1.33,58.69),比活性对照组远30米。
安全性上,在49周的双盲活性对照期间,2例(2%)Nexviazyme组患者和3例(6%)对照组患者报告了严重不良反应。Nexviazyme组最经常报告的不良反应(>5%)是头痛,瘙痒,恶心,荨麻疹和疲劳。13例(25%)Nexviazyme组患者和16例(33%)对照组患者报告了输注相关反应。
多例Nexviazyme组报告的输注相关反应为轻度至中度,包括头痛、腹泻、瘙痒、荨麻疹和皮疹。
无重度输注相关反应。
在美国,预计赛诺菲(Sanofi)对销售Nexviazyme报价为:
- 儿童患者每年约 $330,000 美元
- 成人患者每年约 $758,000 美元
Nexviazyme(Avalglucosidase alfa-ngpt)艾夫糖苷酶 是一种酶替代疗法,旨在改善GAA向肌肉细胞的递送。为了减少糖原积累,GAA必须被递送到肌肉细胞内的溶酶体中。通过靶向在GAA运输中起关键作用的甘露糖-6-磷酸(M6P)受体,来增强GAA向肌肉细胞溶酶体中的递送。与标准治疗α-葡萄糖苷酶相比,Nexviazyme的M6P含量增加约15倍,旨在帮助改善细胞对酶的摄取并增强目标糖原清除。此前 Nexviazyme已获得FDA授予治疗庞贝病的突破性疗法认定和快速通道资格。
庞贝病(糖原累积病II型)是一种进行性、使人衰弱的肌肉疾病,会损害人的行动和呼吸功能。庞贝病是由溶酶体中的酸性α-葡萄糖苷酶(GAA)的遗传缺陷或功能障碍引起的。GAA会导致全身肌肉细胞中糖原的积累,从而导致不同肌肉不可逆的损伤,包括支持呼吸功能的膈肌和影响人体活动、功能耐力和呼吸的骨骼肌。而将GAA酶转运到细胞内溶酶体的关键途径就是M6P受体。
 扫一扫
扫一扫