2023年11月15日(新泽西州伯克利高地)生物制药公司 CorMedix Inc.宣布美国食品和药物管理局美国食品和药物管理局 (FDA) 已批准DefenCath ®(Taurolidine and Heparin)牛磺罗定和肝素 封管溶液 (CLS),用于通过中心静脉导管接受慢性血液透析的少数肾衰竭成年患者,降低导管相关血流感染 (CRBSI) 的发生率(CVC)。
- DefenCath 是美国第1个也是唯一1个获得 FDA 批准的抗菌 CLS,在 3 期临床研究中显示可将 CRBSI 风险降低高达 71%。
FDA 对 DefenCath 的批准得到了随机、双盲、主动对照、多中心关键 3 期 LOCK-IT-100 临床试验结果的支持,该试验旨在评估 DefenCath 降低肾病患者 CRBSI 发生率的有效性和安全性长期血液透析失败。在这项研究中,共有 806 名受试者被随机分配接受 DefenCath 或肝素作为 CLS。与对照组患者相比,DefenCath 组患者的 CRBSI 事件发生率较低。风险比为 0.29,相当于发生 CRBSI 的风险在统计上显着降低了 71%。独立的数据安全和监测委员会根据已证实的疗效和预先指定的统计显着性水平建议提前终止该研究,且不存在安全问题。不良事件与对照组相当。
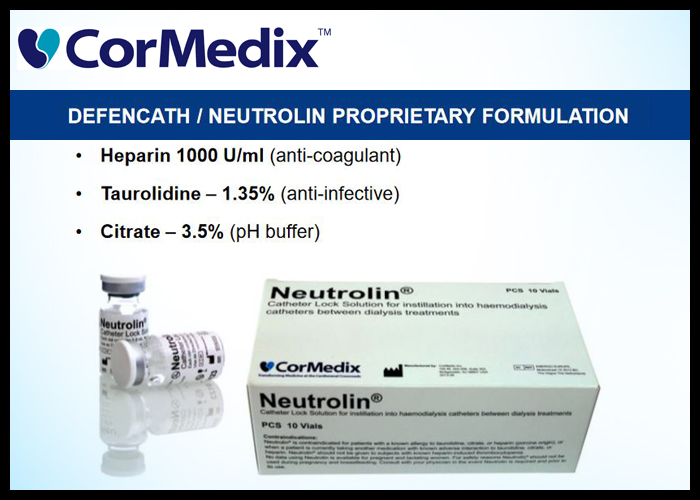
DefenCath (Taurolidine and Heparin) 牛磺罗定和肝素 是一种经 FDA 批准的抗菌导管封管溶液 (Catheter lock solution,CLS),用于减少通过中心静脉导管 (CVC) 接受慢性血液透析的有限肾衰竭成年患者的导管相关血流感染 (CRBSI) 的发生率。它由抗凝剂肝素和牛磺罗定组成,牛磺罗定是一种广谱非抗生素抗菌剂和抗真菌剂。DefenCath 设计用于在透析期间占据导管腔。在欧洲,微生物对牛磺罗定的耐药性尚未在实验室或临床使用中得到记录,可能是由于化学作用机制所致。
DefenCath 的批准是根据《21 世纪治愈法案》建立的抗菌和抗真菌药物有限人群(LPAD)途径,旨在解决严重细菌和真菌感染患者未满足的需求。此外,FDA 还指定 DefenCath 为根据《立即产生抗生素激励法案》(GAIN) 设立的合格传染病产品 (QIDP),该法案支持开发治疗严重或危及生命的感染的抗菌和抗真菌产品。FDA 批准 DefenCath 用于降低通过中心静脉导管接受慢性血液透析的成年肾衰竭患者与导管相关的血流感染的发生率。它适用于有限的特定患者群体。除通过 CVC 接受慢性 HD 的成年肾衰竭患者外,DefenCath 的安全性和有效性尚未确定。
DefenCath 含有Taurolidine [牛磺罗定(一种噻二嗪类抗菌剂)]和Heparin [肝素(一种抗凝剂)],可诱发血小板减少症或 HIT,并且是禁忌的,不应用于已知 HIT 或对牛磺罗定、肝素或柠檬酸盐过敏的患者。它不适合全身给药。在开始下一次血液透析之前,必须从导管中吸出 DefenCath 并丢弃。
使用 DefenCath 作为导管封管溶液的 LOCK-IT-100 患者中,最常报告的不良反应为血液透析导管故障、出血/出血、恶心、呕吐、头晕、肌肉骨骼胸痛和血小板减少症,发生率≥ 2%。DefenCath 组和肝素组分别有 5% (18/398) 和 5% (21/399) 的患者出现导致死亡的不良反应。DefenCath 组和肝素组分别有 17% (69/398) 和 18% (72/399) 发生导致停止研究药物的不良反应。
除通过 CVC 接受慢性血液透析的成年肾衰竭患者外,DefenCath 的安全性和有效性尚未确定。DefenCath 不适合全身给药,因此母亲使用预计不会导致胎儿接触该药物,并且母乳喂养预计不会导致婴儿接触该药物。未使用 DefenCath 进行动物繁殖研究。DefenCath 在儿科患者中的安全性和有效性尚未确定。65 岁患者与老年和年轻患者之间没有观察到安全性或有效性的总体差异。
导管相关血流感染 (Catheter-related bloodstream infection,CRBSI) 在中心静脉导管 (CVC) 患者中很常见。大约 80% 开始血液透析的患者将插入 CVC 以建立血管通路。CRBSI 可能发生在多达三分之一的 HD-CVC 患者中,超过 50% 的 CRBSI 发生在 CVC 插入后的前 3 个月内。每年,使用中心静脉导管 (CVC) 等血管内装置的患者会发生约 250,000 例 CRBSI,导致约四分之一的感染患者死亡。CRBSI 可能导致更多的住院患者、更长的住院时间以及心血管事件等长期并发症。血液透析中的 CRBSI 由多种病原体引起,其中许多病原体具有抗生素耐药性。
| 信息 | 来源 |
| FDA approves new drug under special pathway for patients receiving hemodialysis | https://www.fda.gov/drugs/news-events-human-drugs/fda-approves-new-drug-under-special-pathway-patients-receiving-hemodialysis?utm_medium=email&utm_source=govdelivery |
| 免责声明 | 本资料仅作参考,诊疗请遵医嘱。 |
 扫一扫
扫一扫