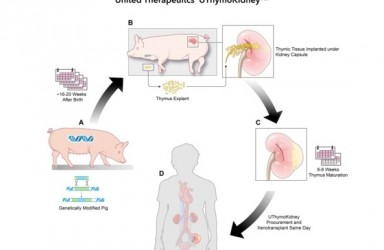
2020年01月09日,美国FDA宣布批准Blueprint Medicines公司开发的Ayvakit(avapritinib)上市治疗无法切除或转移性胃肠道间质瘤(GIST)成人患者。
- 这些患者携带PDGFA外显子(exon)18突变,其中包括携带PDGFRA D842V突变的患者,这是最常见的外显子18突变。

美国FDA的批准是基于名为NAVIGATOR的1期临床试验的疗效结果,以及多项临床试验的安全性结果。在携带PDGFRA外显子18突变的GIST患者中,Ayvakit达到84%的总缓解率(95 CI: 69%,93%),7%的患者达到完全缓解,患者的中位缓解持续时间(DOR)尚未达到。
Ayvakit作为4线疗法治疗GIST的新药申请的审评仍在进行中,目前该申请的PDUFA日为2020年2月14日。FDA可能将PDUFA日延期3个月,让Blueprint公司递交Ayvakit在3期临床试验VOYAGER中获得的顶线数据。这一临床试验比较Ayvakit与瑞戈菲尼(Regorafenib)作为3线或4线疗法,治疗GIST患者的效果。
在美国,30天用量Ayvakit(avapritinib)阿维普替尼 需要支付$32,000美元。
Ayvakit(avapritinib)阿维普替尼/阿泊替尼 是一款强力的高特异性KIT和PDGFRA突变激酶抑制剂。
- Ayvakit已经表现出抑制与GIST相关的广泛KIT和PDGFRA突变体的效力。该药获得FDA授予的突破性疗法认定,以及快速通道资格,孤儿药资格和优先审评资格。
- 这是首款获批治疗具有特定基因组特征GIST患者的靶向疗法,GIST是一种由基因突变驱动的胃肠道肉瘤,源于胃肠道壁中的特殊神经细胞。大约6%的新确诊患者携带PDGFA外显子18突变。最常见的突变为D842V突变,导致患者对所有其它获批疗法产生抗性。
胃肠道间质瘤(Gastrointestinal stromal tumor,GIST)大约6%的新确诊患者携带PDGFA外显子18突变。最常见的突变为D842V突变,导致患者对所有其它获批疗法产生抗性。
 扫一扫
扫一扫