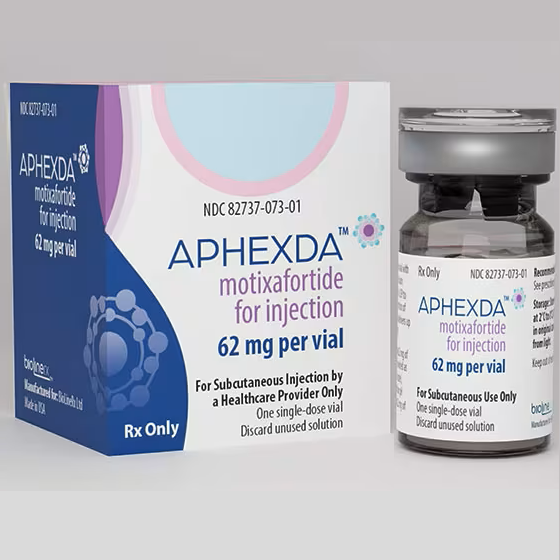
2023年09月11日(特拉维夫)BioLineRx宣布,美国FDA已批准Aphexda(motixafortide)联合非格司亭(Filgrastim)(粒细胞集落刺激因子G-CSF)动员造血干细胞至外周血,以作为多发性骨髓瘤患者在移植时促进患者自体移植的干细胞动员(SCM)。
- Aphexda是十年来首个在多发性骨髓瘤干细胞动员方面获得FDA批准的创新药物。
FDA此次批准主要是基于两部分的GENESIS临床3期试验的结果,该试验是一项随机双盲、安慰剂对照的研究,评估了Aphexda加G-CSF,相比安慰剂加G-CSF动员造血干细胞用于多发性骨髓瘤患者自体移植的安全性和有效性。第一部分是一项单中心、导入期、开放标签研究,包含12例接受Aphexda与G-CSF治疗的患者,旨在确定药物使用剂量。第二部分包含122例患者,为一项随机双盲、安慰剂对照的多中心研究。
CD34阳性细胞采集的评估同时由中央和地方实验室进行。中央实验室评估结果用于药物的有效性分析,当地实验室结果则用于评估临床治疗决策。根据中央实验室的测量结果,Aphexda加G-CSF联合方案使得67.5%的患者在两次单采治疗中达到干细胞实现采集每公斤≥600万个CD34阳性细胞的目标,而此数值在安慰剂加G-CSF方案组当中仅为9.5%。而根据当地实验室的测量,有92.5%的Aphexda组患者在最多两次单采治疗中达到干细胞采集目标,此数值在安慰剂组为21.4%。
Aphexda与G-CSF联合方案通常显示良好的耐受性以及安全性特征。GENESIS试验中最常见的不良反应(发生率>20%)是注射部位反应(疼痛、红斑和瘙痒)、瘙痒、潮红和背痛。
Aphexda(motixafortide)是CXCR4抑制剂,通过皮下注射给药。趋化因子受体(CXC chemokine receptor 4,CXCR4)是一个具有7次跨膜结构的G蛋白耦联受体(GPCR),是肿瘤细胞表达最为普遍的趋化因子受体之一,并且参与炎症反应、调控造血等多种生理机制。此前全球仅有1款CXCR4拮抗剂Mozobil(plerixafor)释倍灵(普乐沙福)上市。
多发性骨髓瘤(Multiple myeloma,MM)是第二常见的血液系统恶性肿瘤。自体干细胞移植(ASCT)是多发性骨髓瘤标准疗法的一部分,可延长该癌症类型患者的生存期。ASCT的成功取决于治疗过程中干细胞的充分动员。美国移植和细胞治疗学会(ASTCT)指南推荐的采集目标为根据患者体重,每公斤采集300-500万个CD34阳性细胞。根据统计,高达47%的患者在单次采治疗后难以收集足够用于ASCT的干细胞数量。
| 信息 | 来源 |
| BioLineRx Announces FDA Approval of APHEXDA™ (motixafortide) in Combination with Filgrastim (G-CSF) to Mobilize Hematopoietic Stem Cells for Collection and Subsequent Autologous Transplantation in Patients with Multiple Myeloma | https://ir.biolinerx.com/news-releases/news-release-details/biolinerx-announces-fda-approval-aphexdatm-motixafortide |
| 免责声明 | 本资料仅作参考,诊疗请遵医嘱。 |
 扫一扫
扫一扫