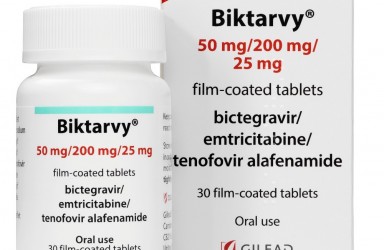
2022年11月29日(加利福尼亚州福斯特城)吉利德科学公司宣布,欧盟委员会(EC)已批准一种新的低剂量片剂剂型 Biktarvy ®(bictegravir 30 mg/emtricitabine 120 mg/tenofovir alafenamide 15 mg tablets,BIC/FTC/TAF)比克替拉韦30 毫克/恩曲他滨120 毫克/替诺福韦艾拉酚胺15 毫克片剂 和扩展Biktarvy 用于治疗至少2岁且体重至少 14 公斤的病毒学抑制儿童的 HIV 感染的适应症。
欧洲上市许可是 Biktarvy 在欧盟 (EU) 的第一个儿科批准,适用于欧盟所有 27 个成员国,以及挪威、冰岛和列支敦士登。
Biktarvy 用于治疗至少两岁且体重至少 14 公斤的儿童的 HIV 的扩展适应症和产品线扩展的授权是基于一项开放标签研究(NCT02881320),发现 Biktarvy 在病毒学抑制的青少年和感染 HIV 的儿童中有效且在 24 周内普遍耐受良好。在研究 1474 中,Biktarvy 的治疗结果在 12 岁至 18 岁以下、体重至少 35 公斤(治疗队列 1,N=50)的病毒学抑制青少年和 6 岁至以下的病毒学抑制儿童中进行了评估体重至少 25 公斤的 12 岁以上(治疗队列 2,N=50)。还在至少 2 岁且体重至少 14 公斤至低于 25 公斤的病毒学抑制儿童中评估了 Biktarvy 的治疗结果(治疗队列 3,N = 22)。在第 2 周或第 4 周,从三个治疗组中选择的研究参与者接受了强化药代动力学 (PK) 评估,以确认每个治疗组的给药剂量。来自三个治疗队列的所有参与者继续接受 Biktarvy 治疗 48 周。在第 48 周之后,参与者可以在长达 96 周的活跃开放标签扩展阶段接受 Biktarvy。
改用 Biktarvy 后,治疗队列1中 98% (49/50) 的参与者仍然受到抑制(HIV-1 RNA)。
Biktarvy 在欧盟适用于治疗 HIV 感染的成人和儿科患者,年龄至少2岁,体重至少14公斤,目前或过去没有证据表明对整合酶抑制剂类、恩曲他滨或替诺福韦有病毒耐药性。Biktarvy 不能治愈 HIV 或 AIDS。
Biktarvy(bictegravir/emtricitabine/tenofovir alafenamide,BIC/FTC/TAF,30mg/120mg/15mg)必妥维(比克替拉韦/恩曲他滨/丙酚替诺福韦,30mg/120mg/15mg)低剂量片剂是一种完整的 HIV 治疗方法,它结合了三种强大的药物,形成最小的基于 3 种药物的整合酶链转移抑制剂 (INSTI) 单片方案 (STR),提供简单的每日一次给药,有或没有食物,与有限的药物相互作用潜力和高耐药性屏障。Biktarvy 是一种完整的STR,不应与其他HIV药物一起服用。
儿童艾滋病毒 2021 年,每天约有 850 名儿童感染艾滋病毒,约有 301 名儿童死于艾滋病相关原因,主要原因是无法充分获得艾滋病毒护理和治疗服务。在这些大多数可预防的死亡中,约有 72% 发生在 10 岁以下的儿童中。为儿童和青少年提供适当剂量的新配方代表了未满足的需求,这是与 HIV 感染者的长期健康和保健相关的重要考虑因素。
虽然在儿童和青少年的艾滋病毒治疗方面取得了许多进展,但仍然需要为全世界数百万儿童确定优先次序、评估和制定选择方案。到 2021 年,估计仍有 800,000 名 19 岁以下感染艾滋病毒的儿童仍未接受艾滋病毒治疗。2021 年,儿童占 HIV 感染者的 4%,但占 AIDS 相关死亡人数的 15%,儿童和成人在 HIV 治疗覆盖率方面的差距正在扩大而不是缩小。
| 信息 | 来源 |
| European Commission Grants Expanded Marketing Authorization for Gilead’s Biktarvy® for the Treatment of HIV in Pediatric Populations | https://www.businesswire.com/news/home/20221128005858/en/ |
| 免责声明 | 本资料仅作信息参考,诊疗请遵医嘱。 |
 扫一扫
扫一扫