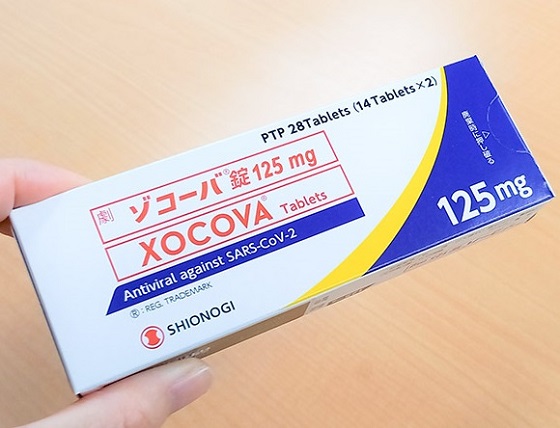
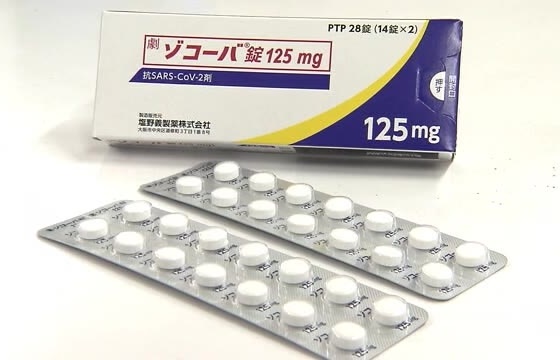
2022年11月22日(日本大阪) 盐野义(Shionogi & Co., Ltd.)宣布 Xocova ®(ensitrelvir fumaric acid, Code No.: S-217622) 富马酸恩司特韦,一种针对 COVID-19 的新型抗 SARS-CoV-2 药物获得日本厚生劳动省 (MHLW) 的紧急监管批准,用于 SARS 的适应症-CoV-2 感染。
此次紧急批准是基于 Xocova ®的预期疗效及其安全性的可接受性,其基于通过第 2 阶段(497 例,包括 2a 和 2b 部分合并)和第 3 部分(1,821 例)获得的结果) 2/3 期研究。Xocova ®是第一个在轻度至中度 SARS-CoV-2 感染患者中显示出对五种典型 Omicron 相关症状(主要终点)的临床症状疗效和抗病毒疗效(关键次要终点)的抗病毒药物,无论风险因素或在流行病的 Omicron 主导阶段期间的疫苗接种状况。
该批准是根据《药品和医疗器械法》第 14-2-2 条规定的紧急监管批准制度授予的。此外,根据盐野义和 MHLW 于 2022 年 3 月签署的Xocova ®国内供应基本协议,与 MHLW 签订的日本政府购买 100 万疗程 Xocova ®的合同现已生效。Shionogi 将努力获得标准批准Xocova ®将与 MHLW 讨论在日本向一般分销的过渡。Shionogi 将继续寻求全球注册,包括与药品专利池合作以提供 LMIC 的准入,并扩大和加强我们的制造和全球供应链,同时积累更多关于有效性和安全性的证据。
Xocova ®是一种口服抗病毒剂,每天给药一次,持续五天,通过选择性抑制病毒 3CL 蛋白酶来抑制 SARS-CoV-2 的复制。Shionogi 于 2022 年 2 月 25 日根据 2/3 期临床试验2、3、4的 2b 期部分获得的结果在日本申请制造和销售批准,要求在“有条件批准制度”下进行审查。5月27日,盐野义制药根据修改后的药品医疗器械法新设立的“紧急监管审批制度”重新提交了审查申请。药品和医疗器械局(PMDA)的审查一直在进行中,Xocova ®的紧急批准在今天举行的药物事务和食品卫生委员会会议上进行了审议,包括新提交的第 3 阶段部分的顶线结果,证明了主要终点的实现。
Xocova ®(ensitrevir fumaric acid)富马酸恩司特韦 是目前在日本紧急监管审批制度下获得批准的 COVID-19 抗病毒药物,是北海道大学和盐野义联合开发的一款口服3CL蛋白酶抑制剂,其作用机制与辉瑞获得批准的COVID-19药物Paxlovid相同。SARS-CoV-2 有一种叫做 3CL 蛋白酶的酶,它对病毒的复制至关重要。Xocova® _通过选择性抑制 3CL 蛋白酶来抑制 SARS-CoV-2 的复制。
目前,仅针对无症状/轻度症状的 SARS-CoV-2 感染者的 2/3 期研究的 2b/3 期部分正在亚洲进行,主要是在日本。在安全性方面,恩西瑞韦的耐受性良好,研究中没有出现与治疗相关的严重不良事件或死亡。最常见的与治疗相关的不良事件是高密度脂蛋白的短暂降低和血液甘油三酯的升高,如先前研究中所观察到的那样。一项针对非住院 SARS-CoV-2 感染患者的全球 3 期试验(SCORPIO-HR 研究6 )正在进行中。此外,全球 3 期试验(STRIVE 研究7) 针对住院的 SARS-CoV-2 感染患者计划很快启动。一项针对 SARS-CoV-2 感染者的家庭成员的发病预防研究和一项针对 12 岁以下儿童的儿科研究也在准备中。
| 信息 | 来源 |
| Xocova® (Ensitrelvir Fumaric Acid) Tablets 125mg Approved in Japan for the Treatment of SARS-CoV-2 Infection, under the Emergency Regulatory Approval System | https://www.shionogi.com/global/en/news/2022/11/e20221122.html |
| 免责声明 | 本资料仅作参考,诊疗请遵医嘱。 |
 扫一扫
扫一扫