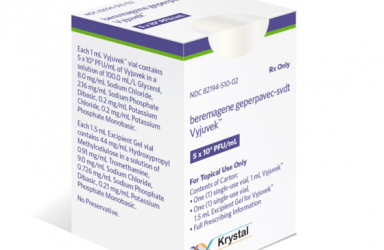
2023年05月19日(匹兹堡),Krystal Biotech公司宣布,美国FDA已批准其基因疗法Vyjuvek(beremagene geperpavec-svdt,B-VEC)用于治疗营养不良性大疱性表皮松解症(DEB)。
- VYJUVEK 是有史以来第1个可重复基因疗法,也是第1个也是唯一1个被 FDA 批准用于治疗 DEB 的药物,包括隐性和显性,可以由医疗保健专业人员在医疗保健专业人员环境或家中进行使用。
这一批准得到了3期临床试验积极结果的支持。去年12月发表在《新英格兰医学杂志》上的结果显示,接受治疗6个月后,DEB患者身上接受Vyjuvek治疗的伤口中67%完全愈合(p<0.005),而接受安慰剂治疗的伤口完全愈合的比例仅为22%;在治疗3个月时,与安慰剂相比(20%),71%接受Vyjuvek治疗伤口完全愈合(p<0.005)。Vyjuvek的耐受性良好,未报告药物相关严重不良事件或因治疗而停药,其免疫原性特征(通过抗HSV-1和抗COL7抗体测定)与既往研究一致。

Vyjuvek(beremagene geperpavec-svdt,B-VEC)是一款现货型(off-the-shelf)外用基因疗法,旨在为患者的皮肤细胞提供两个COL7A1基因的正常拷贝,生成功能性VII型胶原蛋白(COL7)蛋白,针对导致疾病的根本机制进行治疗,这款基因疗法通过基因工程改造的HSV-1载体来进行基因递送。
Vyjuvek是一款使用单纯疱疹病毒(HSV)载体的获批基因疗法,它的上市也代表着基于非腺相关病毒(AAV)载体基因疗法的开发取得了关键性进展。HSV-1是一种双链DNA病毒,它的基因组完全以染色体外(episomal)形式存在,其大小可以轻松容纳大型或多个基因,并且它可以转导分裂和非分裂的细胞,不会整合到宿主细胞基因组中,也不会以其他方式破坏宿主基因组。在人体中,HSV-1可以有效地避免被免疫系统清除,并且不会诱导广泛的中和抗体反应,从而降低宿主发生免疫相关不良反应的风险。此外,除了其天然感染部位(皮肤和粘膜),HSV-1的入侵受体广泛表达于多种人类细胞类型,因此它能够有效地被递送至多个组织和器官系统。
营养不良性大疱性表皮松解症(Dystrophic Epidermolysis Bullosa,DEB)是一种罕见的严重疾病,影响皮肤和粘膜组织。
DEB是由COL7A1基因中的一个或多个突变引起,该基因负责产生VII型胶原蛋白(COL7),形成将真皮(皮肤内层)与表皮(皮肤外层)结合的锚定纤维。DEB患者缺乏功能性锚定纤维,导致极度脆弱的皮肤因轻微摩擦或创伤而起泡和撕裂。DEB患者遭受开放性创伤,会导致皮肤感染,纤维化可导致手指和脚趾融合,并最终增加发展为侵袭性鳞状细胞癌的风险,严重时可能致命。
| 信息 | 来源 |
| Krystal Biotech Receives FDA Approval for the First-Ever Redosable Gene Therapy, VYJUVEK™ (beremagene geperpavec-svdt) for the Treatment of Dystrophic Epidermolysis Bullosa. | https://www.globenewswire.com/news-release/2023/05/19/2672756/0/en/Krystal-Biotech-Receives-FDA-Approval-for-the-First-Ever-Redosable-Gene-Therapy-VYJUVEK-beremagene-geperpavec-svdt-for-the-Treatment-of-Dystrophic-Epidermolysis-Bullosa.html |
| 免责声明 | 本资料仅作参考,诊疗请遵医嘱。 |
 扫一扫
扫一扫