2023年06月22日(洛杉矶)人工智能 (AI) 数字健康公司Eyenuk,已获得美国食品和药品管理局的批准美国食品和药物管理局 (FDA) 批准使用 Topcon NW400 视网膜相机及其EyeArt AI 系统来自动检测糖尿病视网膜病变 (DR),增加了已批准使用 Canon CR-2 AF 和 Canon CR-2 Plus AF 相机的功能。
EyeArt v2.2.0 系统获得监管许可,使其成为第1个也是唯一1个经 FDA 批准可与不同制造商的多个视网膜相机一起使用的人工智能系统。此次批准建立在EyeArt 系统于2020 年 8 月推出 的基础上,该系统是第1个也是唯一1个获得 FDA 批准的人工智能技术,用于检测轻度 DR 和威胁视力的 DR。在欧盟,EyeArt系统是第1个也是唯一1个获得 MDR IIb 类批准的人工智能系统, 可在一次测试中检测 DR、年龄相关性黄斑变性和青光眼性视神经损伤。
自在全球市场推出以来,EyeArt系统已被数百家诊所使用,为超过 230,000 名糖尿病患者和计数患者提供安全可靠的眼部筛查。
FDA 对EyeArt v2.2.0 系统的最新许可是基于一项前瞻性多中心临床试验 (ClinicalTrials.gov ID NCT04984200) 的临床数据,该试验证明了 Topcon NW400 相机的卓越性能,总结如下。
- 对于轻度 DR 检测,灵敏度为 94.4%,特异性为 91.1%,并且
- 威胁视力的 DR 检测灵敏度为 96.8%,特异性为 91.6%
此外,通过此次许可,EyeArt系统获得了升级的图像质量评估模块和 Eyenuk 专有的实时图像质量反馈解决方案。这些增强功能提高了EyeArt系统的可用性,无需散瞳即可实现一流的分级能力(即提供结论性报告的患者百分比)。
在临床试验中,对于所有相机型号(佳能 CR-2 AF、佳能 CR-2 Plus AF 和 Topcon NW400),90.4% 的病例无需散瞳即可获得结论性EyeArt结果,99% 的病例无需散瞳即可获得结论性 EyeArt 结果质量反馈解决方案推荐扩容后进行扩容。
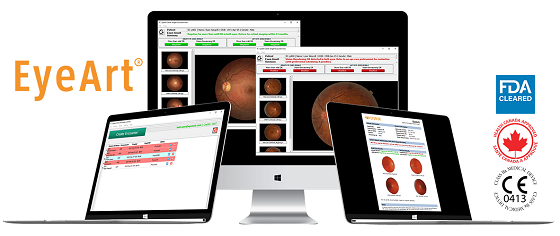
关于EyeArt人工智能系统
EyeArt AI 系统根据国际临床标准和立即报告,在一次就诊期间提供对糖尿病视网膜病变 (DR)、年龄相关性黄斑变性 (AMD) 和青光眼视神经损伤(包括视网膜成像)的完全自主筛查。病人的定期检查。一旦捕获患者的眼底图像并将其提交给EyeArt AI 系统,检测结果将在不到 30 秒的时间内以 PDF 报告形式提供。
EyeArt AI系统是在美国国立卫生研究院的资助下开发的,并得到了英国国家卫生服务局的验证。根据欧盟医疗器械法规 2017/745(“MDR”),EyeArt AI 系统在欧盟获得了 CE 标记,属于 IIb 类医疗器械,用于检测 DR、AMD 和青光眼视神经损伤。此外,该系统还获得美国食品和药物管理局 510(k) 许可以及加拿大卫生部的 DR 自主检测许可证。它的设计符合通用数据保护条例 (GDPR) 和 1996 年健康保险流通与责任法案 (HIPAA)。
EyeArt AI 系统可由美国政府和私人付款人根据第 1 类现行程序术语 (CPT) 代码 92229 进行补偿。
| 信息 | 来源 |
| New FDA Clearance Makes Eyenuk the First Company with Multiple Cameras for Autonomous AI Detection of Diabetic Retinopathy. | https://www.prnewswire.com/news-releases/new-fda-clearance-makes-eyenuk-the-first-company-with-multiple-cameras-for-autonomous-ai-detection-of-diabetic-retinopathy-301857717.html |
| 免责声明 | 本资料仅作参考,诊疗请遵医嘱。 |
 扫一扫
扫一扫