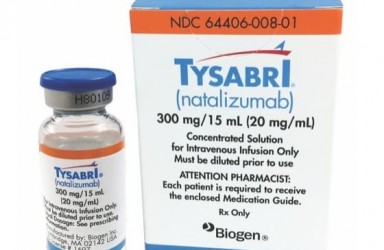
2023年08月25日(巴塞尔)山德士(Sandoz)宣布,美国食品和药物管理局 (FDA) 已批准其由 Polpharma Biologics 开发的生物仿制药 Tyruko ® (natalizumab-sztn)那他珠单抗。Tyruko 被批准用于治疗参考药物涵盖的所有适应症,并且是 FDA 批准的第1个也是唯一1个用于治疗复发型多发性硬化症 (MS) 的生物仿制药。
Tyruko 被批准作为单一疗法,用于治疗参考药物 Tysabri ® *(那他珠单抗)涵盖的所有复发型多发性硬化症适应症,包括临床孤立综合征 (CIS)、复发缓解型多发性硬化症 (RRMS) 和活动性继发进展性疾病,以及成人克罗恩病。
FDA 基于强大的数据包(包括分析、功能和临床数据)批准了该产品。该批准附有安全警告标签以及风险评估和缓解策略(REMS)。
Tyruko 与参比药具有相同的静脉 (IV) 剂型、给药途径、给药方案和外观。Sandoz 致力于 Tyruko 患者安全的各个方面,Tyruko 推出后将通过 Sandoz REMS 计划提供。
山德士于 2019 年与 Polpharma Biologics 签署了 Tyruko 的全球商业化协议。根据该协议,Polpharma Biologics 将继续负责 Tyruko 活性物质的开发、制造和供应。通过全球独家许可,山德士有权在所有市场进行商业化和分销。山德士致力于尽快将这种重要的药物带给美国患者。
Tyruko® (natalizumab-sztn) 那他珠单抗 ,Tyruko 与原研为渤健的Tysabri高度相似,Tysabri是一种成熟、高效的抗 α4 整合素单克隆抗体,用于治疗复发型多发性硬化症 (MS)。Tyruko 在美国被批准作为复发型多发性硬化症的单一疗法,包括临床孤立综合征 (CIS)、复发缓解型多发性硬化症 (RRMS) 和活动性继发进展性疾病,以及成人克罗恩病。
多发性硬化症 (MS) 是一种进行性慢性炎症和中枢神经系统神经退行性疾病,可严重影响日常生活。大多数多发性硬化症患者会经历一段时期的新症状或复发,但部分或完全改善,然后是疾病缓解期。
那他珠单抗适用于治疗成人复发型多发性硬化症的单一疗法,包括临床孤立综合征、复发缓解型疾病和活动性继发进展性疾病。那他珠单抗产品会增加进行性多灶性白质脑病 (PML) 的风险。因此,那他珠单抗只能通过专门的风险评估和缓解策略 (REMS) 计划获得。当开始和继续使用 TYRUKO 治疗时,医生应考虑 TYRUKO 的预期益处是否足以抵消这种风险。
进行性多灶性白质脑病 (Progressive multifocal leukoencephalopathy ,PML) 风险是一种罕见的机会性脑部病毒感染,与死亡或严重残疾有关。导致 PML风险增加的因素有:表达抗JC病毒抗体、既往使用免疫抑制剂以及那他珠单抗治疗持续时间较长。同时存在三个风险因素的患者发生PML的风险最高。在开始和继续使用那他珠单抗治疗时,医生应考虑那他珠单抗的预期获益是否足以抵消这种风险。
克罗恩病 (CD) TYRUKO 适用于对患有中度至重度活动性克罗恩病且有炎症证据且对常规 CD 疗法和抑制剂反应不足或无法耐受的成年患者诱导和维持临床反应和缓解。肿瘤坏死因子-α。TYRUKO 不应与免疫抑制剂(例如,6-巯基嘌呤、硫唑嘌呤、环孢素或甲氨蝶呤)或 TNF-α 抑制剂联合使用。
| 信息 | 来源 |
| Sandoz receives FDA approval for Tyruko® (natalizumab-sztn), first and only FDA-approved biosimilar for relapsing forms of multiple sclerosis. | https://www.globenewswire.com/news-release/2023/08/25/2731654/0/en/Sandoz-receives-FDA-approval-for-Tyruko-natalizumab-sztn-first-and-only-FDA-approved-biosimilar-for-relapsing-forms-of-multiple-sclerosis.html |
| 免责声明 | 本资料仅作参考,诊疗请遵医嘱。 |
 扫一扫
扫一扫