2023年12月08日,美国FDA宣布批准bluebird bio开发的基因疗法Lyfgenia(lovotibeglogene autotemcel,lovo-cel)的生物制品许可申请(BLA),用于治疗12岁及以上患有镰刀型细胞贫血病(SCD)且有血管闭塞事件(VOE)史的患者。
Lyfgenia的安全性和有效性基于对12至50岁镰刀型细胞贫血病和VOE病史患者进行的一项为期24个月的单臂多中心研究的数据分析。根据患者在接受Lyfgenia输注后6至18个月内达成VOE完全消退(VOE-CR)来评估有效性。在此期间,32例患者中有28名(88%)达到了VOE-CR。
Lyfgenia最常见的副作用包括口腔炎(嘴唇、口腔和喉咙的口腔溃疡)、血小板、白细胞和红细胞水平低下,以及发热性中性粒细胞减少症(发烧和白细胞计数低)。正在进行的长期随访将继续提供关于Lyfgenia治疗后的疗效、安全性和患者体验的重要信息。
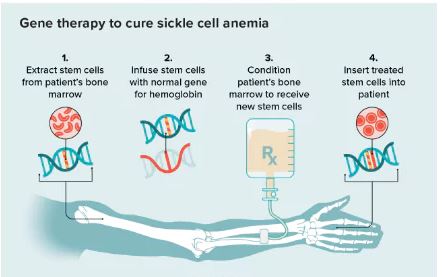
Lyfgenia(Lovotibeglogene autotemcel,lovo-cel)使用慢病毒载体(基因递送载体)进行基因改造,其设计目的是将改良形式的 HbAT87Q [β-珠蛋白基因(βA-T87Q珠蛋白基因)] 的功能拷贝添加到患者自身的造血干细胞(HSCs)中。一旦患者具有βA-T87Q珠蛋白的基因,他们的红细胞可以产生能够抵抗血红细胞镰刀化的血红蛋白(HbAT87Q),从而降低镰状血红蛋白(HbS)的比例,目标是减少镰状红细胞、溶血和其他并发症。FDA此前已经授予Lyfgenia孤儿药资格、快速通道资格、再生医学先进疗法认定(RMAT)和罕见儿科疾病认定。
Lyfgenia和今日同时获得批准的Casgevy是用于治疗12岁及以上的镰状细胞病患者首批获得批准的细胞基因疗法。这2种产品均由患者自身的血液干细胞制成,经过修饰后,作为造血(血液)干细胞移植的一部分,以一次性单剂量输注的形式返回。在治疗之前,收集患者自身的干细胞,然后患者必须接受清髓性调理(高剂量化疗),该过程从骨髓中去除细胞,以便用 Casgevy 和 Lyfgenia 中的修饰细胞替换它们。
镰刀型细胞贫血病(Sickle Cell Disease,SCD)又称为镰状细胞病、镰状细胞贫血(SCA),是一种常染色体显性遗传血红蛋白病。SCD使人衰弱且危及生命的血液疾病,
| 信息 | 来源 |
| FDA Approves First Gene Therapies to Treat Patients with Sickle Cell Disease. | https://www.fda.gov/news-events/press-announcements/fda-approves-first-gene-therapies-treat-patients-sickle-cell-disease |
| bluebird bio Announces FDA Approval of LYFGENIA™ (lovotibeglogene autotemcel) for Patients Ages 12 and Older with Sickle Cell Disease and a History of Vaso-Occlusive Events | https://www.businesswire.com/news/home/20231208492260/en/bluebird-bio-Announces-FDA-Approval-of-LYFGENIA%E2%84%A2-lovotibeglogene-autotemcel-for-Patients-Ages-12-and-Older-with-Sickle-Cell-Disease-and-a-History-of-Vaso-Occlusive-Events |
| 免责声明 | 本资料仅作参考,诊疗请遵医嘱。 |
 扫一扫
扫一扫